盐类的水解解析如下:
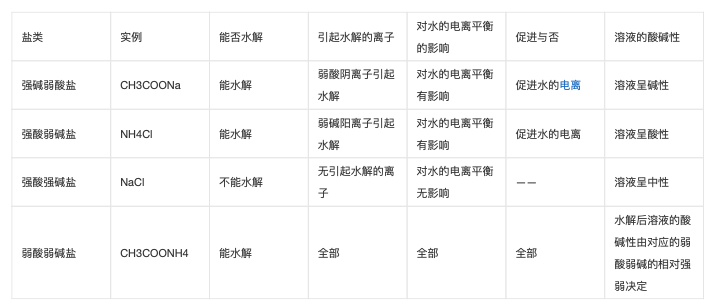
在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解。并使水的电离平衡向正方向移动,从而促进水的的电离。盐类的水解所需条件:盐必须溶于水,盐必须能电离出弱酸根离子或弱碱阳离子。在溶液中,强碱弱酸盐,强酸弱碱盐粗拍答或弱酸弱碱盐电离出来的离子与水电离出来的H+与OH-生成弱电解质的过程叫做盐类水解。
⒈实质:在溶液中,由于盐电离出的离子与水电离出的离子结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,显示出不同浓度的酸性、碱性或中性。
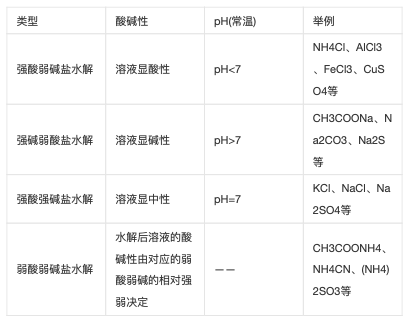
⒉规律:难溶不水解,有弱才水贺岁解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性,弱弱具体定;越热越水解,越稀越水解。
(即盐的构成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决岩慧定,酸强显酸性,碱强显碱性。)
3.特点:
⑴水解反应和中和反应处于动态平衡,水解进行程度很小。
⑵水解反应为吸热反应。
⑶盐类溶解于水,以电离为主,水解为辅。
⑷多元弱酸根离子分步水解,以第一步为主。
版权声明:文章由 百问九 整理收集,来源于互联网或者用户投稿,如有侵权,请联系我们,我们会立即处理。如转载请保留本文链接:https://www.baiwen9.com/article/104698.html