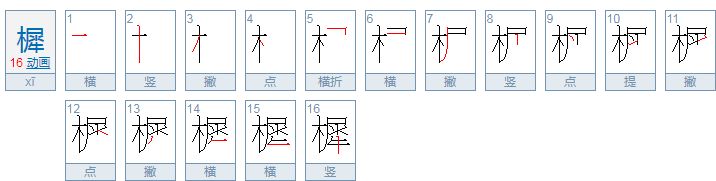
一、原子轨道不同:
1s 2s 是亚层,不是轨道。1s和2s是不同的原子轨道。
一个电子亚层可能只有一个原子轨道(s亚层),也可能有多条原子轨道,p亚层有3条原子轨道,d亚层有5条原子轨道,f亚层有7条原子轨道。
二、轨道用途不同:
如果一个原子有5个电子,那么,它是硼原子,它的电子在1s轨道中排2个,在2s轨道中排2个,在2px轨道上排1个,2py和2pz则为空轨道,不需要用到3s轨道,每个s轨道都只能容纳2个电子。、
电子的自旋是电子运动状态的一种描述方式,微观粒子的运动与宏观物质不同,比较抽象,自旋向上和向下是其本身的状态,不是受什么其它物质影响的,向上和向下也可以相互转变,不过需要足够大的能量突破自旋禁阻。
三、形状不同:
主量子数和角量子数都相同才能算同一能级。就是数字和字母必须都一样才行。
电子在原子核外的原子轨道中绕原子旋转,1S轨道最靠近原子核,2S轨道在1S外层,1S轨道和2S轨道的形状都是球形,只是2S轨道中有节点。
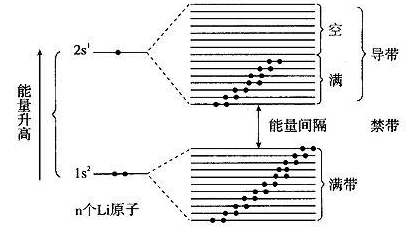
扩展资料:
在多电子原子中,当价电子进入原子实内部时,内层电子对原子核的屏蔽作用减小,相当于原子实的有效电荷数增大,也就是说电子所受到的引力增大,原子的体系能量下降,所以由此可以容易得出,当主量子数n相同时,不同的轨道角动量数l所对应的原子轨道形状不一样,即当价电子处于不同的轨道时,原子的能量降低的幅度也不一样,轨道贯穿的效果越明显,能量降低的幅度越大。
s,p,d,f能级的能量有大小之分,这种现象称为“能级分裂”,屏蔽效应产生的主要原因是核外电子间静电力的相互排斥,减弱了原子核对电子的吸引:s能级的电子排斥p能级的电子,把p电子“推”离原子核,p、d、f之间也有类似情况。
参考资料来源:百度百科-原子轨道