原电池反应是氧化还原反应。
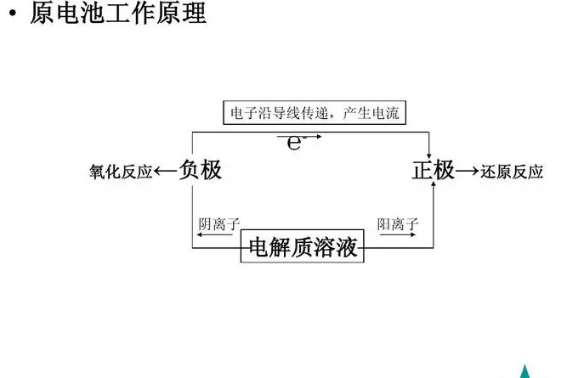
将化学能转变为电能的装置称为原电池。在原电池中,发生的化学反应如唤是氧化还原反应。发生氧化反应的一极上有电子流出,做负极,失去电子的物质是还原剂。电子通过原电池的负极经导线流向正极,在正极上氧化剂得到电子,发生还原反应。原电池就是通过化学反应实现化学能向电能转化的。
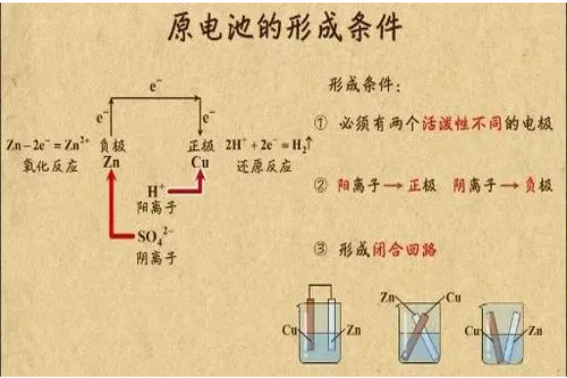
组成原电池有四个不可缺少的条件(极、电、路、自发):
1、两种活泼性不同的金属(或另一种为非金属导体)构成电极。
2、电解质溶液。
3、形成闭合回路。
4、氧化还原反应能自发进行。
原电池正负电极的判断:
1、根据电极材料:较活泼一极为负,较或橡告不活泼的一极为正(与电解质反应得失电子)。
2、根据两极发生的反应:发生氧化反应的一极为负,还原反应的一极为正。
3、根据电极增重还是减重:溶解或减轻的一极为负,增加或放出气泡的一极为正; (铅酸电池(Pb-PbO2)可作为经典特例:放电时,由于正极PbO2反应后变为PbSO4,负极Pb反应后也变为PbSO4,重量均有增加衫明,溶液溶质H2SO4有所减少。)
4、根据电子或电流流动方向:电流方向:正→负 电子流向:负→正。
5、根据溶液中离子运动方向:阴离子移向的一极为负,阳离子移向的一极为正。